大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
通过甲基转移酶对真核RNA的N6-甲基腺苷(m6A)进行可逆调控是影响RNA代谢的一种重要表观遗传事件。因此,m6A甲基化在调控动物生长、发育、繁殖和疾病进展中发挥着至关重要的作用。本文回顾了m6A甲基化修饰的最新研究进展,并讨论了其在家畜生长、发育和繁殖性状中的调控作用,展望了m6A甲基化修饰在塑造经济重要性状中的研究前景。
m6A的基本调控机制
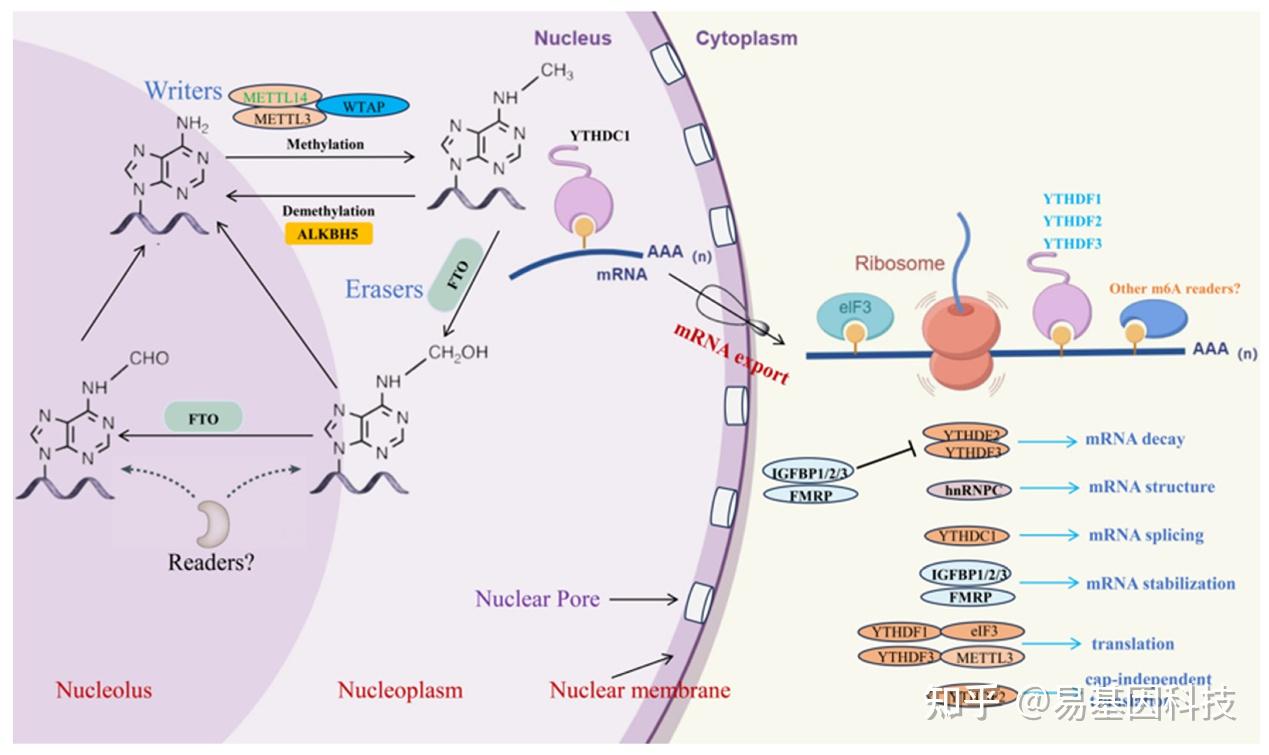
m6A修饰是一种常见的RNA修饰类型,其可以改变RNA分子的化学属性和空间结构,从而影响其功能性。m6A修饰动态可逆,参与多种酶之间的复杂互作,包括甲基转移酶(如METTL3、METTL14和WTAP)、去甲基化酶(如FTO、ALKBH5和ALKBH3)以及m6A结合蛋白(如YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2)。研究表明,m6A修饰可以影响mRNA的剪接、稳定性、出核和翻译,以及miRNA的加工和功能(图1)。
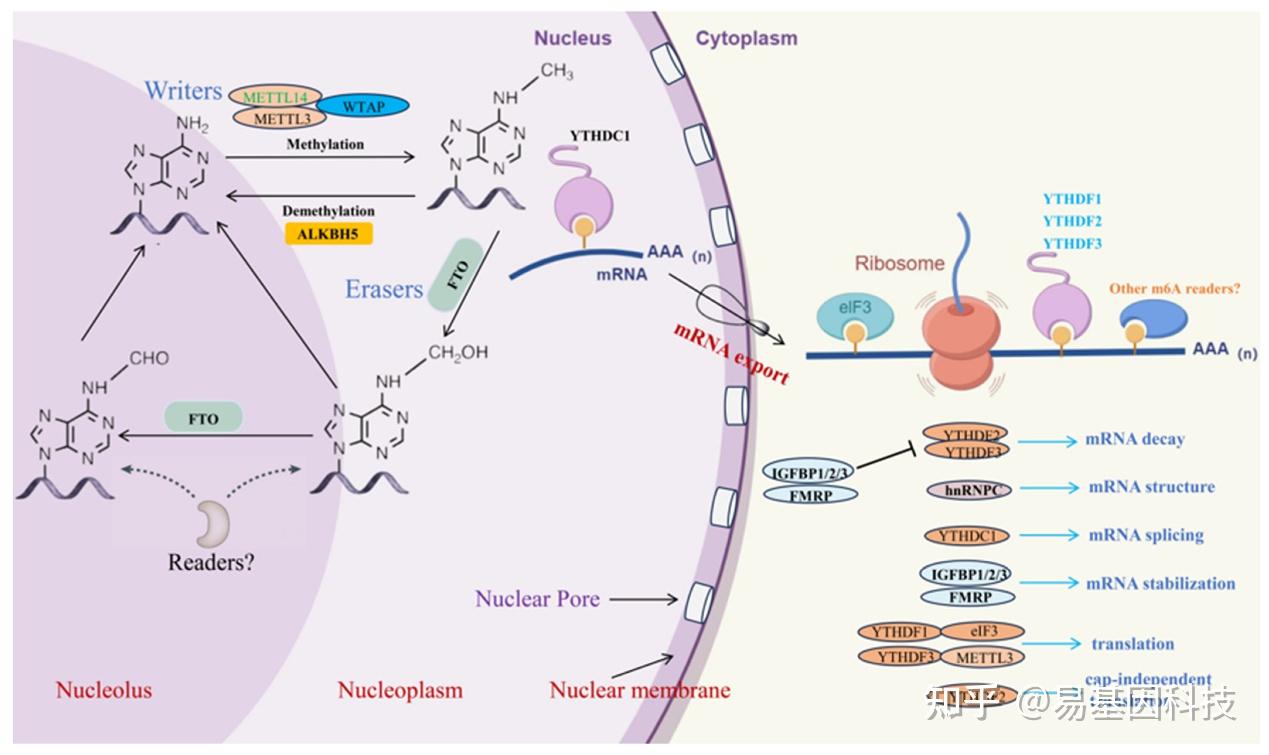
图1:m6A甲基化修饰的动态过程。负责添加m6A修饰酶是蛋白质复合体,包括 METTL3、METTL14、WTAP 和其他组分。FTO蛋白是一种去甲基化酶,通过其核心结构域C末端的独特long loop区域作用,以去除RNA中的甲基化。ALKBH5是另一种去甲基化酶,通过氧化过程去除带有m6A修饰的RNA的甲基化。诸如YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2等reader蛋白参与了包括mRNA剪接、稳定性、翻译和出核在内的各种过程。
m6A 修饰在动物生长发育中的作用
(1)m6A修饰在肌肉发育中的调控作用
作为最丰富的mRNA修饰类型,m6A在骨骼肌分化、心肌重塑和再生中发挥着调控作用。在猪胚胎发育的6个不同阶段中,m6A修饰显示出高度动态变化,大多数受影响的基因富集在与骨骼肌发育相关的通路中。猪产前骨骼肌中的m6A甲基化水平在胚胎年龄E40(原始肌纤维形成期)时显著降低,随着胚胎年龄增加(E50-95天,次级肌纤维形成期),甲基化水平逐渐增加。通过siRNA沉默IGF2BP1可以促进增殖并抑制肌细胞分化。骨骼肌发育在家畜高效肉类生产中的核心地位突显了m6A修饰对产品质量的重要性。山羊研究表明,FTO可以通过降低m6A修饰程度来增加GADD45B mRNA的稳定性和表达,从而激活p38MAPK通路并促进肌细胞分化。METTL3蛋白也可以通过上调m6A水平和增强MEF2C表达来促进山羊骨骼肌卫星细胞的肌源性分化。这些研究为通过RNA甲基化调控山羊肌生成提供了潜在的分子机制。
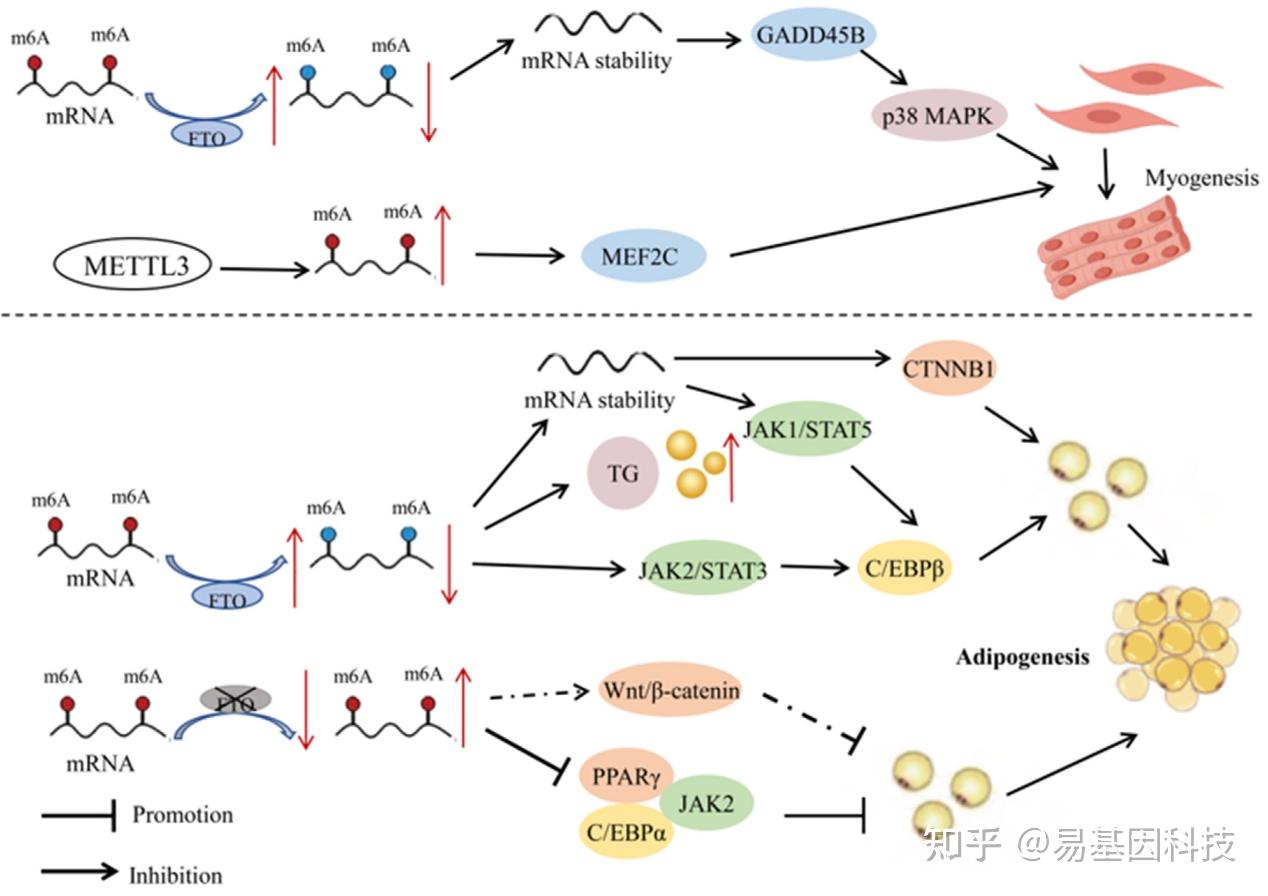
图2:RNA甲基化在家畜肌肉和脂肪发育中的机制。在肌细胞中,FTO通过降低m6A修饰程度以增加GADD45B mRNA的稳定性和表达,从而激活p38MAPK通路,促进肌细胞分化。另一方面,METTL3通过上调m6A水平和增强MEF2C表达,促进山羊骨骼肌卫星细胞的分化。在脂肪细胞中,FTO通过去甲基化调控JAK2-STAT3-C/EBPβ信号通路,促进猪前脂肪细胞分化。FTO过表达还可以显著增加细胞中的甘油三酯(TG)含量。此外,FTO通过调控CTNNB1表达促进鸡前脂肪细胞增殖和分化。沉默FTO显著降低PPARγ和C/EBPα表达,抑制猪肌内前脂肪细胞的增殖。它还可能通过Wnt/β-catenin通路参与猪肌内前脂肪细胞分化。在猪骨髓源性间充质干细胞(BMSCs)中,METTL3缺失增加了JAK1 mRNA稳定性,通过JAK1-STAT5信号通路激活C/EBPβ,从而诱导BMSCs分化为脂肪细胞。红色和蓝色圆点分别代表高甲基化和低甲基化状态。虚线表示潜在的调控机制。符号:↑表示上调;↓表示下调。
在对牛的研究中,m6A甲基化转移酶METTL3对成肌细胞增殖具有抑制作用,并能促进细胞分化;它还能通过影响TM4SF1稳定性来调控成肌细胞发育。YTHDF2介导的TM4SF1 mRNA降解也依赖于m6A修饰。成年牛背最长肌中m6A去甲基化酶(FTO和ALKBH5)的表达显著高于新生牛,而m6A甲基转移酶(METTL3、METTL14和WTAP)的表达则较低。在肌生成过程中,这五个基因的mRNA表达显著增加;在牛成肌细胞中的干扰实验进一步表明,m6A甲基化相关酶可能调控牛骨骼肌发育。
在京星黄(Jingxing-Huang)鸡中,m6A去甲基化酶基因ALKBH5和FTO在骨骼肌发育过程中的表达水平显著增加。ALKBH5和FTO蛋白可能通过调控RNA m6A甲基化水平影响鸡骨骼肌发育。有证据表明METTL3、METTL14和WTAP在家禽肌纤维类型组成、维持和成肌细胞分化中具有调控作用。
m6A是影响非编码RNA(ncRNA)功能的关键调控因子,从而参与生物体的生长和发育。METTL3过表达降低了分化C2C12细胞和肌肉损伤再生小鼠模型中肌肉特异性miR-1a、miR-133a、miR-133b和miR-206表达。研究人员使用RNA-seq和MeRIP-seq技术分析了猪氧化和糖酵解骨骼肌中lncRNAs的m6A甲基化模式。结果显示,大多数lncRNAs在最后一个外显子中有一个优先富集的m6A peaks,且m6A水平与lncRNAs表达水平之间存在正相关。此外,lncRNA MSTRG.14200.1的抑制延迟了卫星细胞分化,并刺激了快速和慢速肌纤维之间的转换。这项研究为猪肌纤维类型的转换提供了新的目标。在牛-牦牛骨骼肌中,m6A丰度与基因表达水平呈正相关,但与lncRNA表达水平呈负相关,表明m6A修饰可能在牛-牦牛骨骼肌的发育中发挥重要作用,但m6A修饰对mRNA和lncRNA的调控机制可能不同。RNA-seq和ATAC-seq测序技术的使用允许发现骨骼肌特异性lncRNA MYH1G-AS,其转录由转录因子SMAD3和SP2协调。此外,SP2抑制ALKBH5的转录,降低了ALKBH5对MYH1G-AS的去甲基化,从而MYH1G-AS RNA稳定性失衡。MYH1G-AS加速了成肌细胞的增殖,但抑制其分化;这个基因促进了慢速肌纤维向快速肌纤维的转换,并导致肌肉萎缩。总体而言,这些一致的结果表明m6A甲基转移酶在家畜骨骼肌发育中发挥重要的调控作用。
(2)m6A修饰在脂肪生成中的调控
有证据表明m6A修饰可以调控转录因子和脂肪组织特异性基因的表达水平,从而影响脂肪沉积代谢过程。其中,FTO作为一种RNA去甲基化酶,在修饰基因表达中发挥重要作用。例如,在猪脂肪细胞中FTO和METTL3基因的过表达和特异性敲除揭示了FTO与m6A甲基化水平呈负相关,而与脂肪生成呈正相关。而METTL3与m6A甲基化水平呈正相关,与脂肪生成呈负相关。在猪骨髓源性间充质干细胞(BMSCs)中,METTL3缺失导致JAK1 mRNA上的m6A修饰减少,进而增强了JAK1 mRNA的稳定性和翻译效率。JAK1-STAT5信号通路是调节脂肪细胞分化的关键通路之一,通过磷酸化STAT5激活与脂肪生成相关的下游基因,如C/EBPβ,并促进其进入细胞核,从而引导BMSCs向脂肪细胞分化。FTO酶通过m6A去甲基化促进猪的前脂肪细胞分化,通过调节JAK2-STAT3-C/EBPβ信号通路、有丝分裂克隆扩增和细胞自噬通路。在猪肌内前脂肪细胞中,沉默FTO显著降低了磷酸组蛋白H3水平,并抑制肌内前脂肪细胞增殖。沉默FTO还导致过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT/增强子结合蛋白α(C/EBPα)下调,以及β-catenin表达的上调。LiCl(一种Wnt/β-catenin信号通路的特异性激活剂)可以减弱FTO诱导的PPARγ上调和β-catenin下调。在猪脂肪细胞中,FTO过表达显著增加了细胞内甘油三酯含量,并显著上调了与脂肪生成相关基因的C/EBPβ表达,同时下调了脂肪分解基因ATGL和HSL的mRNA表达;FTO敲低会导致不同结果,表明这种蛋白可能促进猪脂肪细胞中脂质的积累。总之,沉默 FTO 会减少猪肌内脂肪前细胞的增殖和分化,并可能通过 Wnt/β-catenin 通路影响猪肌内脂肪前细胞的分化。
在中国本土鸡种中,腹部脂肪过度沉积一直是家禽生产中的一个重大问题。高脂饮食可能导致体重增加和过度脂肪沉积,影响脂肪代谢和脂肪生成的基因和通路。在鸡的前脂肪细胞中,RNA m6A甲基化与脂肪生成呈负相关。FTO过表达显著抑制m6A水平,并促进鸡的前脂肪细胞的增殖和分化,而沉默FTO则产生相反结果。FTO酶通过去甲基化调控CTNNB1表达,从而促进鸡的脂肪沉积。有研究报告称,与新生牛相比,秦川成年牛脂肪组织中的m6A甲基转移酶METTL3、METTL14和WTAP以及m6A去甲基化酶FTO和ALKBH5都显著上调。它们在体外前脂肪细胞增殖和分化过程中的表达模式也表现出显著差异。这些结果表明m6A修饰可能在家牛的脂肪沉积中发挥重要作用,m6A甲基转移酶在调控牛的前脂肪细胞的增殖和分化中具有潜在作用。
当前研究表明,许多环状RNA(circRNA)分子具有多个m6A修饰位点。例如,在黔山黑猪和大白猪的背最长肌中鉴定出12个候选m6A修饰circRNA(m6A-circRNA);这些m6A-circRNA可以作为miRNA海绵分子,并通过构建ceRNA调控网络来调控脂肪沉积。富集分析显示,m6A-circRNA的亲本基因及其吸附的miRNA靶基因参与与脂肪沉积、细胞增殖和分化相关通路,表明m6A-circRNA在决定猪肉品质方面可能特别重要。这些一致的发现表明,m6A甲基转移酶在家牛、猪和家禽的脂肪沉积中发挥着至关重要的作用。
m6A修饰在家畜繁殖性状中的功能性作用
(1)m6A修饰对精子发生的调控
精子发生是一个高度复杂和特殊的细胞发育过程,包括精原细胞增殖、精母细胞减数分裂和精子形成三个阶段。精子发生过程中的基因表达在转录、转录后和翻译水平上受到严格调控,以确保阶段特异性基因的准确表达。以往的研究使用m6A RNA甲基转移酶METTL3和/或METTL14的条件性基因敲除小鼠模型揭示了METTL3或METTL14在早期精原细胞中的缺失会导致精原干细胞凋亡。然而,只有在相对较晚阶段的精原细胞(A1型精原细胞)中同时敲除METTL3和METTL14,才会影响精子形成。在人类中,WTAP和ALKBH5表达在精子发生过程中减少;FTO和ALKBH5在哺乳动物的睾丸中高表达,人类FTO基因突变与精液质量下降密切相关。有研究报告称,ALKBH5基因缺陷的雄性小鼠由于减数分裂中期精原细胞凋亡而生育能力降低。山羊睾丸发育中ALKBH5表达上调,山羊精原干细胞中ALKBH5过表达促进了从G1期到S期转变并抑制凋亡。研究人员使用m6A-seq、RNA-Seq和核糖体分析技术,生成了精子发生不同发育阶段m6A RNA修饰的动态图谱。研究结果表明m6A甲基转移酶失活导致m6A RNA修饰水平下降,从而导致参与精原细胞命运决定和精子形成的基因转录和翻译效率发生显著变化。
转录延伸标记H3K36me3介导m6A修饰的共转录过程。H3K36me3与m6A甲基转移酶复合体中的METTL3和METTL14互作,促进新生RNA m6A修饰。组蛋白和RNA修饰之间的这种交流为mRNA-m6A的生物发生提供了新的概念。尽管DNA甲基化和m6A修饰是独立过程,但它们可能共同影响基因表达和精子发生的调控。非编码RNA作为表观遗传调控因子,在精子发生过程中起着重要作用。其中,miRNA、circRNA和PiRNA在转录、转录后和翻译水平上调节雄性生殖细胞的正常发育,并可能与m6A修饰互作。先前的研究表明,在小鼠GC-1精原细胞中,敲低METTL3后,构建的circRNA-miRNA-mRNA调控网络揭示了H2afx和Dnmt3a是精子减数分裂中的枢纽基因。这项研究可能为由异常m6A修饰引起的异常精子发生的病理机制提供新的见解和潜在的治疗靶点。
猪生殖细胞中的所有mRNA转录本都含有m6A修饰,m6A的reads密度在编码序列(CDS)中增加,并在终止密码子附近达到最高值,然后在3’非翻译区(UTR)中降低。在精子发生过程中,转录产物中m6A修饰的丰度随着不同发育阶段而变化。粗线期精母细胞和圆形精子细胞中CDS的m6A修饰reads密度较高,而在精原细胞的30非编码区中较高。METTL3缺失会导致精原细胞分化异常启动,并影响精母细胞在减数分裂前达到粗线期的能力。在粗线期精母细胞中,甲基化基因上调优先参与精子发生和细胞周期过程,这些过程被m6A修饰上调,表明m6A在早期发育阶段的重要作用。此外,PS中的m6A修在参与精子细胞发育基因中富集,并上调参与微管加工、纤毛组织和纤毛组装的基因表达,表明m6A甲基化mRNA可能在精子发生前抑制翻译。在圆形精子细胞中,m6A甲基化基因上调,并调控包括多细胞生物解剖结构和管状形态发生在内的发育过程,表明m6A修饰在介导猪精子发生中的保守性。在雄性生殖细胞发育过程中的m6A RNA修饰保守并受动态调控,广泛存在于精子发生的各个阶段,特别是在粗线期/双线期精母细胞和圆形精子细胞中高度富集。在牛、牦牛和牦牛-牛杂交品种的睾丸组织中,bta-miR-200a通过抑制ALKBH5的表达调控m6A甲基化水平,从而影响m6A靶基因的表达和功能。这些一致的结果表明m6A甲基转移酶可能参与动物精子发生(图3)。
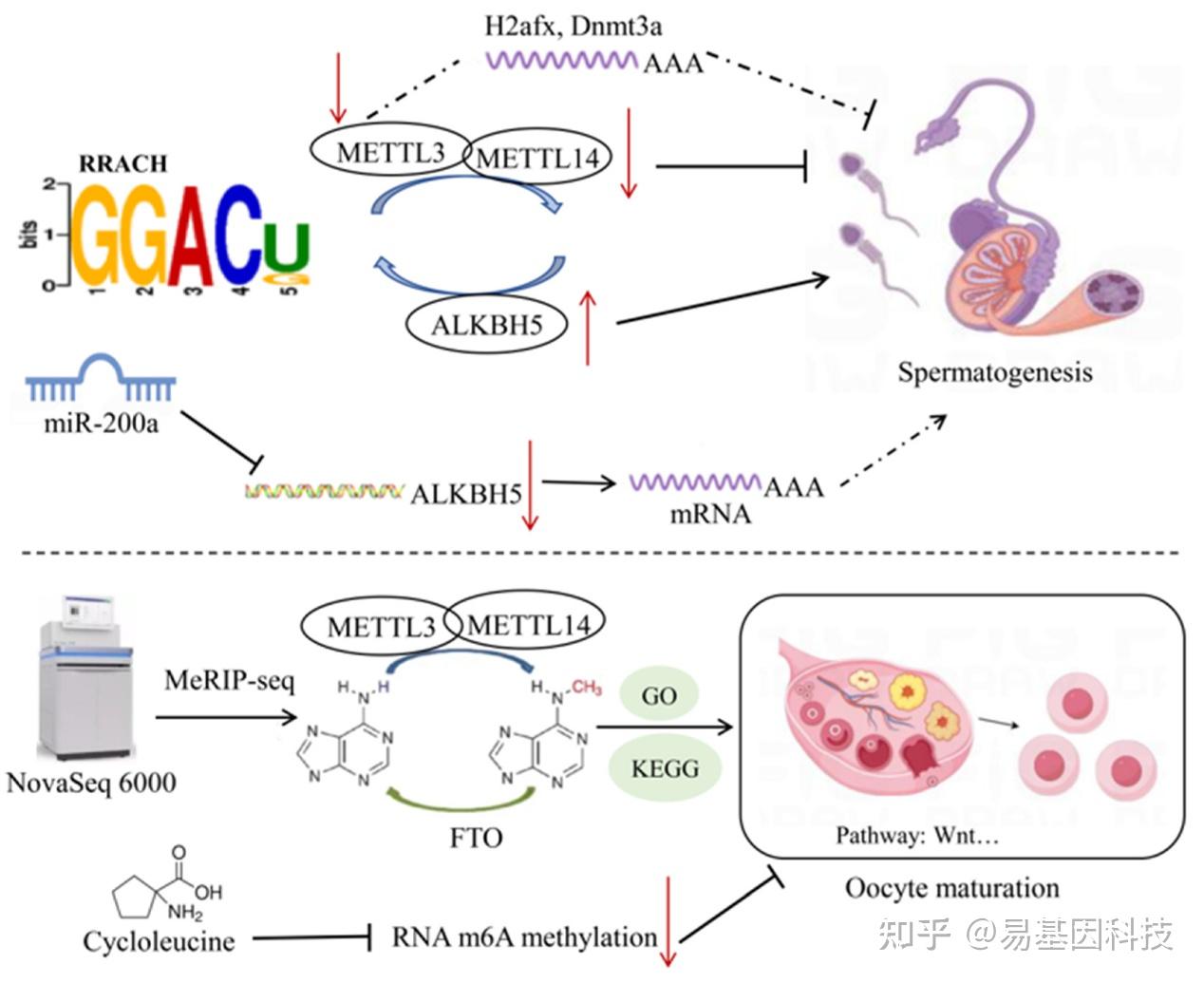
图3:家畜繁殖性状中RNA甲基化机制。小鼠GC-1精原细胞中敲低METTL3后,蛋白-蛋白互作(PPI)网络分析显示核心基因H2afx和Dnmt3a可能在精子发生中发挥作用。在牛睾丸组织中,bta-miR-200a抑制ALKBH5表达,从而影响m6A甲基化对精子发生相关基因的调控。在猪卵母细胞中,环亮氨酸抑制m6A甲基化,从而抑制减数分裂和早期胚胎发育。
(2)m6A修饰对动物卵母细胞成熟的调控
动物卵母细胞成熟可以分为三个主要阶段:减数分裂成熟、细胞质成熟和表观遗传成熟。卵母细胞的表观遗传成熟主要包括调控基因表达的DNA甲基化和组蛋白修饰。m6A甲基化修饰可以影响mRNA降解速率和转录本长度,并阻碍正常的mRNA翻译。这可能导致卵泡发育缺陷、卵母细胞成熟抑制、卵母细胞早期发育停滞和合子基因组激活受损,从而影响和调控雌性哺乳动物的卵母细胞形成各个阶段。
卵母细胞支持胚胎发育能力在卵泡生成过程中获得,与卵泡发育过程中周围颗粒细胞的互作可以影响卵母细胞质量。猪颗粒细胞表现出丰富的m6A基因修饰,从小卵泡(<3毫米)到大卵泡(>5毫米)的转变过程中,m6A甲基化发生动态变化。在小卵泡和大卵泡的颗粒细胞中分别鉴定出7289和6882个m6A位点,m6A在5’UTR或3’UTR附近富集并共有保守motif。进一步分析显示,差异表达的m6A甲基化基因在与类固醇生成、颗粒细胞增殖和卵泡发育相关的多个信号通路中显著富集。总体而言,这些结果突出了猪卵泡发育过程中颗粒细胞中存在不同的m6A修饰,这可能与类固醇和卵泡生成有关。
牦牛的发情周期是一种季节性现象,可能涉及性激素合成和分泌以及对卵泡生长和发育的表观遗传调控。HE染色显示,在发情期卵巢中的发育中卵泡和成熟卵泡数量明显多于黄体期和妊娠期。qPCR结果显示,在卵巢发育的不同阶段,METTL3、METTL14、FTO和YTHDC1的表达存在显著差异,表明m6A修饰在卵巢活动中具有调控作用。通过MERIP-seq技术绘制的牦牛m6A转录组谱显示,在编码序列(CDS)、3’UTR和保守序列“DRACH”中m6A peaks高度富集。GO、KEGG和GSEA分析结果表明,m6A修饰可能参与牦牛卵巢在生殖周期中的许多生理活动。
在家禽研究中,卵泡内的体细胞决定了卵泡的选择过程。在鸡的卵泡选择过程中对m6A甲基化水平分析显示,颗粒细胞和卵泡膜细胞中mRNA甲基化和去甲基化广泛存在,m6A甲基化修饰与基因表达水平呈负相关。在卵泡选择过程中,m6A甲基化peaks和修饰转录本均增加,导致与卵泡生成相关的许多基因表达动态变化。功能富集分析表明,Wnt通路中关键因子的m6A修饰可能在鸡的卵泡选择中发挥主要作用。
先前研究表明,用m6A抑制剂(环亮氨酸)处理卵母细胞可以抑制RNA m6A甲基化和组蛋白修饰,并改变囊胚阶段代谢基因表达,从而抑制猪卵母细胞的减数分裂和早期胚胎发育。这些一致的结果表明,m6A甲基转移酶可能参与主要家畜物种卵母细胞的成熟过程。
总结和观点
m6A修饰,作为一种广泛存在的重要表观遗传修饰,在农业动物的各种生命过程中扮演着重要角色,包括生长和发育、脂质代谢和繁殖(表1)。
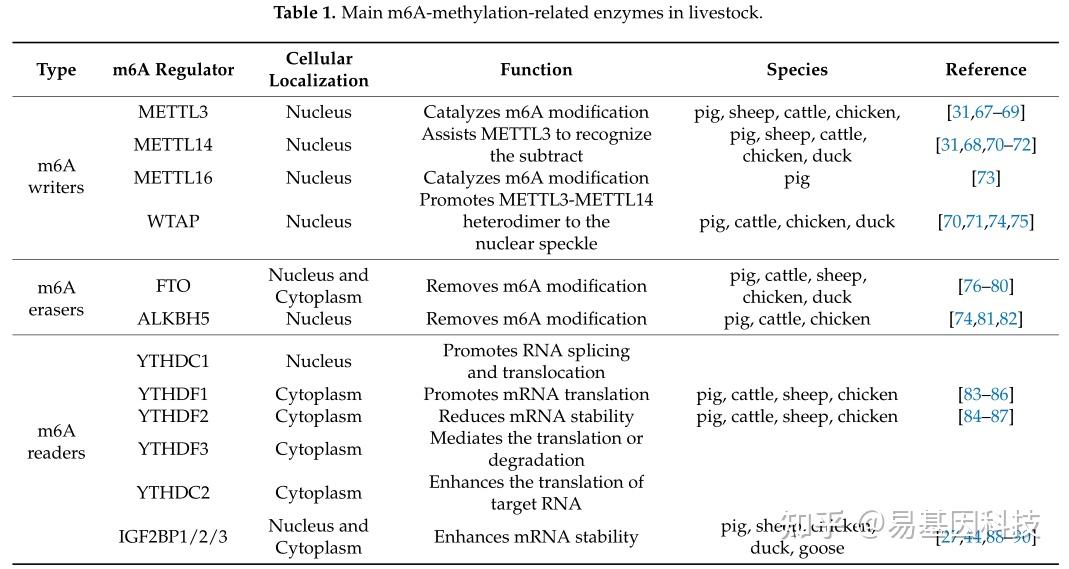
表1:家畜中主要的m6A甲基化相关酶。
近年来,多组学整合分析已成为生命科学领域最重要的研究方法之一。越来越多的研究关注m6A修饰与其他组学数据的综合分析。例如,转录组与m6A之间的相关性可以全面解释转录因子对基因表达和表型差异的调控作用。在子宫内膜癌研究中,通过MeRIP-seq、RNA-seq测序和实验分析,发现IGF2BP1鉴定目标基因PEG10终止密码子附近的m6A甲基化位点,从而调控子宫内膜癌细胞增殖。此外利用全基因组、RNA-seq和功能研究,揭示IGF2BP1基因启动子区域缺失可能是与鸡体型相关数量性状位点的因果变异。
与人类和小鼠的m6A修饰研究相比,家畜的m6A修饰研究相对较少。目前,使用m6A-seq评估m6A修饰在家畜经济性状中的作用的研究主要集中在甲基转移酶、m6A水平以及与性状相关的差异甲基化基因鉴定上。因此,需要进一步研究家畜中RNA甲基化相关酶和甲基化基因的具体功能和调控机制。RNA甲基化研究仍面临许多挑战,如m6A-seq测序技术限制可能导致的假阳性结果,以及缺乏对家畜RNA甲基化动态性质和调控机制的研究。
m6A修饰通常被视为基因表达的调控因子和许多调控通路中的目标。m6A的writers、erasers、readers经常相互交互。在癌症研究中,METTL3可能调控WTAP蛋白稳定性,而WTAP蛋白上调只有在METTL3存在时才具有致癌作用。参与不同类型癌症的m6A相关蛋白通常受到多种m6A蛋白因子调控。由于对m6A了解有限,仍需要广泛研究通路之间的互作以及m6A在调控基因表达中的协同效应。迄今为止,已经发现了多种writers,但只鉴定出两种erasers:FTO和ALKBH5。FTO或ALKBH5的异常表达只会导致生物体整体m6A修饰水平的微小变化,这表明体内可能存在未知的去甲基化酶。因此,新m6A相关酶鉴定仍需要深入的生命科学研究。作为一种重要的RNA表观遗传修饰,需要进一步研究m6A如何与DNA甲基化和组蛋白修饰相互作用来调控基因表达,以及m6A修饰与其他RNA修饰之间的潜在联系。
本文回顾了家畜经济性状中m6A甲基化修饰调控机制的当前知识状态。关于这种表观遗传机制的现有数据和未来的工作将帮助家畜研究领域的研究人员使用有效方法有效研究RNAm6A修饰水平,从而促进开展调控生物重要功能中关键基因表达的研究。利用这些知识,还可以产生新的分子标记或靶点用于定向育种。这些信息可以作为动物经济性状遗传改良的参考,对提高家畜肉类、蛋类和奶类的生产产量和质量具有重要意义。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Ren T, Xu M, Du X, Wang Y, Loor JJ, Lei L, Gao W, Du X, Song Y, Liu G, Li X. Research Progress on the Role of M6A in Regulating Economic Traits in Livestock. Int J Mol Sci. 2024 Jul 31;25(15) pii: ijms25158365. doi: 10.3390/ijms25158365. PubMed PMID: 39125935.
相关阅读:
项目文章:MeRIP-seq+RNA-seq揭示家禽(鸡)脂肪沉积中的m6A RNA甲基化调控机制
项目文章 | MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究








没有回复内容